استخدام تقنية النانو في استهداف الخلايا السرطانية
ثورة النانو في مكافحة السرطان: استهداف دقيق للخلايا الخبيثة
يمثل السرطان تحديًا صحيًا عالميًا مستمرًا، حيث يفتك بملايين الأرواح سنويًا. على الرغم من التقدم الكبير في طرق التشخيص والعلاج، لا تزال الآثار الجانبية للعلاجات التقليدية مثل العلاج الكيميائي والإشعاعي تشكل عبئًا كبيرًا على المرضى، وذلك بسبب عدم قدرتها على التمييز بشكل دقيق بين الخلايا السرطانية والخلايا السليمة. في هذا السياق، تبرز تقنية النانو كحل واعد لإحداث ثورة في علاج السرطان من خلال توفير أدوات فائقة الدقة لاستهداف الخلايا السرطانية بشكل انتقائي، مما يقلل من الأضرار التي تلحق بالأنسجة السليمة ويعزز فعالية العلاج.
مقدمة في عالم النانو وتطبيقاته الطبية:
تشير تقنية النانو إلى هندسة وتصنيع المواد والأجهزة على مقياس النانومتر (جزء من المليار من المتر). في هذا العالم الصغير، تكتسب المواد خصائص فيزيائية وكيميائية فريدة تختلف عن خصائصها على المقاييس الأكبر. وقد فتحت هذه الخصائص الباب أمام تطبيقات مبتكرة في مختلف المجالات، بما في ذلك الطب. في مجال الطب النانوي، يتم استخدام الجسيمات النانوية والأجهزة النانوية لتطوير أنظمة تشخيص وعلاج أكثر فعالية وأقل سمية.
التحديات الحالية في علاج السرطان:
تعتمد العلاجات التقليدية للسرطان بشكل أساسي على تدمير الخلايا سريعة النمو، وهي خاصية مشتركة بين الخلايا السرطانية وبعض الخلايا السليمة في الجسم، مثل خلايا نخاع العظام وبطانة الجهاز الهضمي وبصيلات الشعر. هذا النقص في الخصوصية يؤدي إلى ظهور آثار جانبية خطيرة مثل تساقط الشعر، والغثيان، والقيء، وضعف الجهاز المناعي، مما يؤثر سلبًا على جودة حياة المرضى ويحد من الجرعات العلاجية التي يمكن إعطاؤها.
بالإضافة إلى ذلك، فإن مقاومة الخلايا السرطانية للعلاج هي مشكلة أخرى كبيرة. قد تطور الخلايا السرطانية آليات لمقاومة الأدوية العلاجية، مما يجعل العلاج غير فعال ويؤدي إلى انتكاس المرض. كما أن صعوبة الوصول إلى بعض الأورام، خاصة تلك الموجودة في مناطق يصعب الوصول إليها جراحيًا، تمثل تحديًا آخر يواجه الأطباء.
تقنية النانو: نافذة أمل جديدة في علاج السرطان:
تقدم تقنية النانو حلولًا مبتكرة للتغلب على التحديات التي تواجه علاجات السرطان التقليدية. من خلال تصميم جسيمات نانوية ذات خصائص محددة، يمكن للباحثين تطوير أنظمة علاجية وتشخيصية أكثر دقة وفعالية.
آليات استهداف الخلايا السرطانية بتقنية النانو:
تعتمد استراتيجيات استهداف الخلايا السرطانية باستخدام تقنية النانو على عدة آليات مبتكرة:
- الاستهداف السلبي (Enhanced Permeability and Retention Effect – EPR Effect): تتميز الأوعية الدموية التي تغذي الأورام السرطانية ببنية غير طبيعية ذات مسامات واسعة وفراغات بين الخلايا البطانية، بالإضافة إلى ضعف في نظام التصريف اللمفاوي. تسمح هذه الخصائص للجسيمات النانوية ذات الحجم المناسب بالتسرب من الأوعية الدموية إلى داخل الورم والتراكم فيه بشكل تفضيلي مقارنة بالأنسجة السليمة ذات الأوعية الدموية الطبيعية. يُعرف هذا التأثير بتأثير النفاذية والاحتفاظ المعزز (EPR). يتم استغلال هذا التأثير لتحميل الجسيمات النانوية بالأدوية العلاجية وتوصيلها بشكل مركز إلى الورم.
- الاستهداف النشط (Active Targeting): يتضمن الاستهداف النشط تعديل سطح الجسيمات النانوية بروابط جزيئية محددة (Ligands) تتعرف على مستقبلات (Receptors) موجودة بكثرة على سطح الخلايا السرطانية أو على الخلايا البطانية للأوعية الدموية الورمية، ولكنها قليلة أو غير موجودة على سطح الخلايا السليمة. عند ارتباط هذه الروابط بالمستقبلات المستهدفة، يتم تعزيز امتصاص الجسيمات النانوية المحملة بالعلاج داخل الخلايا السرطانية عن طريق عملية البلعمة (Endocytosis)، مما يزيد من تركيز الدواء داخل الخلايا السرطانية ويقلل من تعرض الخلايا السليمة للدواء. تشمل الأمثلة على الروابط المستخدمة الأجسام المضادة وحيدة النسيلة (Monoclonal Antibodies)، والببتيدات (Peptides)، والأبتامرات (Aptamers)، وجزيئات حمض الفوليك (Folic Acid).
- الاستهداف المستجيب للمحفزات (Stimuli-Responsive Targeting): تعتمد هذه الاستراتيجية على تصميم جسيمات نانوية تستجيب لظروف بيئية فريدة موجودة في محيط الورم أو داخل الخلايا السرطانية، مثل درجة الحموضة المنخفضة (Acidic pH)، أو ارتفاع درجة الحرارة، أو وجود إنزيمات معينة، أو التعرض لضوء أو مجال مغناطيسي خارجي. يمكن تصميم هذه الجسيمات النانوية لإطلاق حمولتها العلاجية بشكل محدد عند تعرضها لهذه المحفزات، مما يزيد من دقة العلاج ويقلل من الآثار الجانبية الجهازية. على سبيل المثال، يمكن تصميم جسيمات نانوية تتحلل وتطلق الدواء عند انخفاض درجة الحموضة الموجودة في البيئة المحيطة بالورم أو داخل الليزوزومات في الخلايا السرطانية.

أنواع الجسيمات النانوية المستخدمة في استهداف السرطان:
تتنوع أنواع الجسيمات النانوية المستخدمة في استهداف الخلايا السرطانية، ولكل منها خصائص فريدة تجعلها مناسبة لتطبيقات محددة:
- الليبوزومات (Liposomes): هي جسيمات كروية نانوية تتكون من طبقة ثنائية من الدهون الفوسفورية تشبه الغشاء الخلوي. يمكن تحميل الليبوزومات بمجموعة واسعة من الأدوية المحبة للماء أو الكارهة للماء، وتتميز بتوافقها الحيوي وقدرتها على الاندماج مع الأغشية الخلوية، مما يسهل توصيل الدواء إلى داخل الخلايا.
- الجسيمات النانوية البوليمرية (Polymeric Nanoparticles): تتكون هذه الجسيمات من بوليمرات طبيعية أو اصطناعية. يمكن التحكم في حجمها وشكلها وخصائص سطحها بسهولة، مما يسمح بتصميمها لتلبية متطلبات استهداف محددة وإطلاق متحكم فيه للأدوية.
- الجسيمات النانوية المعدنية (Metallic Nanoparticles): تشمل جسيمات الذهب والفضة وأكسيد الحديد النانوية. تتميز هذه الجسيمات بخصائص بصرية وحرارية ومغناطيسية فريدة. يمكن استخدام جسيمات الذهب النانوية في العلاج الضوئي الحراري (Photothermal Therapy)، حيث يتم امتصاص الضوء وتحويله إلى حرارة لتدمير الخلايا السرطانية. كما يمكن استخدام جسيمات أكسيد الحديد النانوية في التصوير بالرنين المغناطيسي (MRI) لتتبع توصيل الدواء وفي العلاج المغناطيسي الحراري (Magnetic Hyperthermia).
- الجسيمات النانوية الكربونية (Carbon Nanotubes and Graphene): تتميز هذه المواد النانوية بقوتها الميكانيكية العالية وموصلية الكهرباء والحرارة العالية ومساحة سطحها الكبيرة. يمكن استخدامها كحاملات للأدوية والجزيئات الحيوية، وكذلك في تطبيقات التصوير والعلاج الحراري.
- الدندريميرات (Dendrimers): هي بوليمرات متفرعة ثلاثية الأبعاد ذات بنية محددة للغاية. يمكن تعديل سطحها الداخلي والخارجي لحمل كميات كبيرة من الأدوية وجزيئات الاستهداف.
- الجسيمات النانوية السيليكونية (Silica Nanoparticles): تتميز بتوافقها الحيوي العالي وقدرتها على التعديل السطحي بسهولة وحمل كميات كبيرة من الأدوية. يمكن تصميمها لتكون مسامية، مما يسمح بإطلاق متحكم فيه للدواء.
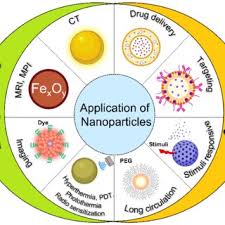
تطبيقات تقنية النانو في علاج السرطان:
تتعدد تطبيقات تقنية النانو في علاج السرطان وتشمل:
- توصيل الأدوية المستهدف (Targeted Drug Delivery): وهو التطبيق الأكثر شيوعًا، حيث يتم تحميل الجسيمات النانوية بالأدوية العلاجية وتوجيهها بشكل انتقائي إلى الخلايا السرطانية، مما يزيد من تركيز الدواء في الورم ويقلل من الآثار الجانبية على الأنسجة السليمة.
- العلاج الجيني (Gene Therapy): يمكن استخدام الجسيمات النانوية لحماية ونقل المواد الجينية العلاجية مثل الحمض النووي الريبوزي المتداخل الصغير (siRNA) أو الحمض النووي الريبوزي المرسال (mRNA) أو الحمض النووي (DNA) إلى الخلايا السرطانية لتعديل التعبير الجيني أو إدخال جينات علاجية.
- العلاج الضوئي الحراري (Photothermal Therapy): تستخدم جسيمات نانوية مثل جسيمات الذهب النانوية التي تمتص الضوء وتحوله إلى حرارة لتدمير الخلايا السرطانية بشكل موضعي عند تسليط ضوء ذي طول موجي محدد على الورم.
- العلاج الديناميكي الضوئي (Photodynamic Therapy): تستخدم جسيمات نانوية لحمل مواد حساسة للضوء (Photosensitizers). عند تنشيط هذه المواد بالضوء، فإنها تنتج أنواعًا من الأكسجين التفاعلي (Reactive Oxygen Species – ROS) التي تقتل الخلايا السرطانية.
- العلاج المغناطيسي الحراري (Magnetic Hyperthermia): تستخدم جسيمات أكسيد الحديد النانوية التي تولد حرارة عند تعرضها لمجال مغناطيسي متناوب، مما يؤدي إلى تدمير الخلايا السرطانية بشكل موضعي.
- التصوير التشخيصي (Diagnostic Imaging): يمكن استخدام الجسيمات النانوية كعوامل تباين محسنة في تقنيات التصوير الطبي مثل التصوير بالرنين المغناطيسي (MRI)، والتصوير المقطعي بالإصدار البوزيتروني (PET)، والتصوير المقطعي المحوسب (CT)، والتصوير بالموجات فوق الصوتية، والتصوير البصري، مما يوفر صورًا أكثر وضوحًا ودقة للأورام ويساعد في الكشف المبكر وتقييم استجابة العلاج.
- التشخيص المبكر (Early Diagnosis): يمكن تصميم الجسيمات النانوية للكشف عن المؤشرات الحيوية السرطانية (Biomarkers) الموجودة بكميات صغيرة جدًا في الدم أو سوائل الجسم الأخرى في المراحل المبكرة من تطور السرطان، مما يفتح الباب أمام التدخل العلاجي المبكر وزيادة فرص الشفاء.
التحديات والآفاق المستقبلية لتقنية النانو في علاج السرطان:
على الرغم من الإمكانيات الهائلة لتقنية النانو في علاج السرطان، لا تزال هناك بعض التحديات التي يجب التغلب عليها قبل أن تصبح هذه التقنيات جزءًا روتينيًا من الرعاية السريرية. تشمل هذه التحديات:
- السمية والتوافق الحيوي: يجب التأكد من أن الجسيمات النانوية المستخدمة آمنة وغير سامة للخلايا والأنسجة السليمة على المدى الطويل.
- التوزيع الحيوي والاستهداف: تحقيق توزيع دقيق ومستهدف للجسيمات النانوية داخل الورم وتجنب تراكمها في الأعضاء الحيوية الأخرى.
- الإنتاج على نطاق واسع والتكلفة: تطوير طرق فعالة من حيث التكلفة لإنتاج الجسيمات النانوية بكميات كبيرة وبجودة عالية.
- الفهم البيولوجي: الحاجة إلى فهم أعمق للتفاعلات المعقدة بين الجسيمات النانوية والأنظمة البيولوجية.
- التنظيم والموافقة: وضع إطار تنظيمي واضح لتطوير وتقييم واعتماد المنتجات النانوية الطبية.
- التغلب على حواجز الجسم: مثل حاجز الدم في الدماغ (Blood-Brain Barrier) لعلاج أورام الدماغ.
- مقاومة الأدوية: تطوير استراتيجيات نانوية للتغلب على آليات مقاومة الأدوية في الخلايا السرطانية.
- التطبيق السريري: ترجمة البحوث الأساسية والتجارب قبل السريرية إلى تطبيقات سريرية ناجحة.
على الرغم من هذه التحديات، فإن الآفاق المستقبلية لتقنية النانو في علاج السرطان واعدة للغاية. مع استمرار التقدم في علوم المواد والهندسة الحيوية والطب، من المتوقع أن نشهد تطور أنظمة نانوية أكثر ذكاءً ودقة وفعالية في استهداف الخلايا السرطانية. تشمل الاتجاهات المستقبلية:
- الأنظمة النانوية متعددة الوظائف: تصميم جسيمات نانوية تجمع بين قدرات التشخيص والعلاج (Theranostics)، مما يسمح بمراقبة استجابة الورم للعلاج في الوقت الفعلي.
- الطب الشخصي النانوي: تصميم علاجات نانوية مخصصة للمرضى بناءً على الخصائص الجينية والجزيئية لأورامهم.
- الذكاء الاصطناعي وتقنية النانو: استخدام الذكاء الاصطناعي لتحسين تصميم الجسيمات النانوية وتحديد استراتيجيات الاستهداف الأكثر فعالية.
- التعاون بين التخصصات: تعزيز التعاون بين علماء النانو والأطباء وعلماء الأحياء لتسريع وتيرة التطور والتطبيق السريري لهذه التقنيات.
خلاصة:
تمثل تقنية النانو أداة قوية وواعدة في مكافحة السرطان. من خلال توفير القدرة على استهداف الخلايا السرطانية بدقة غير مسبوقة، يمكن للجسيمات النانوية أن تحدث ثورة في طرق التشخيص والعلاج، مما يؤدي إلى زيادة فعالية العلاج وتقليل الآثار الجانبية وتحسين نوعية حياة المرضى. على الرغم من التحديات القائمة، فإن التقدم المستمر في هذا المجال يبشر بمستقبل أكثر إشراقًا لمرضى السرطان، حيث ستلعب تقنية النانو دورًا محوريًا في تطوير علاجات أكثر أمانًا وفعالية وشخصية. إن الاستثمار المستمر في البحث والتطوير وتعزيز التعاون بين التخصصات المختلفة أمر ضروري لتحقيق الإمكانات الكاملة لتقنية النانو في التغلب على هذا المرض الفتاك.